中学生を対象にした化学教室を行う予定です。
テーマは『酸化還元』
 中学ではざっくりと、
中学ではざっくりと、
酸化とは、酸素と化合すること。
還元とは、酸素を失うこと。
1つの化学反応で、酸化と還元が同時に起こるんですと、簡単に習います。
 高校では更に、、、
高校では更に、、、
酸化とは、水素を失い、電子を失い、酸化数が増加すること。
還元とは、水素と化合して、電子を得て、酸化数が減少すること。
となり、複雑化していきます。
さらに、、、
酸化する、酸化される、酸化剤、、、
酸化数が増加=酸化される
相手を酸化する=酸化剤(自身は還元される)
などなど。
反応ごとにいろんな言い方ができて国語力?も必要に(笑)
要点を押さえて理解してしまえば簡単なのですが、なかなか頭の中で整理ができない単元の1つのようです。
その酸化と還元をテーマに、いくつかの簡単な実験を中学生に体験してもらい、本校を入試の際に志望してもらおう!!というイベントです。
まぁ、大学のオープンキャンパスのようなもの。
失敗は許されません
昨年度、少し時間が余ってしまったので、今年は1つ実験を増やすことに。
何がいいだろう、、、と担当職員と考えて、
『メチレンブルーの酸化と還元』にしました。
メチレンブルーは、塩基性染料で色素、指示薬として使われ、水溶液はキレイな青色です。
還元剤のグルコースによって、青色のメチレンブルーが還元され無色のロイコメチレンブルーになります
はい。難しいですね
 水酸化ナトリウム水溶液+グルコース(ブドウ糖)溶液
水酸化ナトリウム水溶液+グルコース(ブドウ糖)溶液
無色です。

メチレンブルーを数滴
青色

よく降り混ぜます。
酸素を得て(酸化されて)、青色
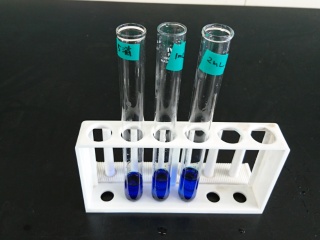
しばらくすると、、、
酸素を失い、
水素を得て(還元されて)
ロイコメチレンブルー(無色)となる。



となります。
さらに、無色になった試験管を振ると酸素を得て、再び青色に。

放置すると、無色に。

という簡単で面白い実験です
生物にも関係しているので、前任校では生物実験のときに簡単に演示実験を行いました。
ただ、、、資料など多くは大きな三角フラスコや丸底フラスコやペットボトルを使っている分量ばかり。
試験管に水酸化ナトリウム水溶液を約5mL入れたときにグルコースの濃度と量、メチレンブルーの濃度と量、温度が不明でした
素早く(10~15秒ほど)キレイに色が簡単に変化する状態の分量を知るために、事前実験を行いました
 水酸化ナトリウム水溶液は、以前成功している比較的薄い濃度0.125mol/L。
水酸化ナトリウム水溶液は、以前成功している比較的薄い濃度0.125mol/L。
グルコース(ブドウ糖)は、他の実験で使用する0.2mol/Lに。
メチレンブルーは、保管してある0.05mol/Lを。
この三種類をどう組み合わせるのかが、問題でした。
 グルコースの量を変えてみたり、、、
グルコースの量を変えてみたり、、、
1滴、3滴、5滴、1mL 1mL 2mLと用意

ロイコメチレンブルーになる速度に変化が!!

グルコースの量がある程度1mL~2mL
くらいの方は早く変化します。

グルコース1滴や3滴は変化はあまり、、、不採用決定。
 メチレンブルーの量を変えてみたり
メチレンブルーの量を変えてみたり
メチレンブルーが大量(5~6滴ドボドボ)
汚い??沈殿が!!

メチレンブルー1~2滴位がキレイです。

濃度を変えてもいいかなあとも思いました。
 あとは、温度。
あとは、温度。
60度、40度と比較してみると、、、
60度に温めておくと、振って2~3秒で変化。
40度は、15秒ほど。

【結論】
18径 試験管1本あたり!!
○水酸化ナトリウム水溶液
約0.1~0.3mol/L 5mL
○グルコース 0.2mol/L 2mL
○メチレンブルー 0.01mol/L 約2滴
温度40~50度ほどでベストかなあ、、、
さてさて、、、
失敗は許されない(笑)ので、もう一度、本番と同じような流れで何回か確認してみます。
クーラーがないので日によって室温など変わります
また、振るときに液が飛び散らないようにゴム栓もしてみようかと。

ドキドキです。