実施している「ろ過の基本操作」の実験に「再結晶」も加えたらどうか?という提案があり、試してみました
〈用意するもの〉
KNO3 硝酸カリウム 5g
CuSO4 硫酸銅 小さじ1
S 硫黄 小さじ1
直径18mm試験管、試験管はさみ、ろうと、ろ紙、300mLビーカー、薬さじ、ガラス棒など。
 硝酸カリウム、硫黄粉末、硫酸銅を分量用意して試験管に入れる。
硝酸カリウム、硫黄粉末、硫酸銅を分量用意して試験管に入れる。


右の試験管は小さじ1。残りを左の試験管に入れてみました。
 純水を8mLほど加える。
純水を8mLほど加える。

硫黄粉末は、二硫化炭素のような有機溶媒には溶けますが水に溶けにくいです。
硝酸カリウムも、硫酸銅も水を加えて振っただけではなかなか、溶けません。
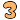 加熱してみます。
加熱してみます。

ここで、溶解度(g/100g水)がポイントになります。
硝酸カリウムと硫酸銅は、温度が高ければ、溶媒(水)に溶ける溶質(硝酸カリウム、硫酸銅)の量は増えます。加熱すると、すぐに水溶液になります。
 ろ過します。
ろ過します。


ろ紙に黄色の粉末が残りました。
硫黄の粉末ですね。
 ろ液をビーカーの水で冷却します。
ろ液をビーカーの水で冷却します。

すぐに白色の結晶が析出してきました。硝酸カリウムと思われます。
温度差による溶解度の違いを利用する「再結晶」という操作です。

 ろ過します。
ろ過します。

ろうと台の代わりに試験管で代用してます。
硝酸カリウムの白色結晶がろ紙に残りました。純水でもう一度洗い、新しいろ紙で再度水分を取ります。

 硝酸カリウムの白色結晶を試験管に入れて、純水を加えます。
硝酸カリウムの白色結晶を試験管に入れて、純水を加えます。

2本用意します。

無色透明の水溶液です。
1本にアンモニア水溶液、もう1本には塩化バリウム水溶液を滴下します。
変化はありません
実験は成功しました。
ろ過、再結晶などの分離操作によって、硫黄の粉末、硝酸カリウムの結晶がキレイに分離できました。

もし、最後のところでアンモニア水溶液を加えて水色から青色(写真↓左)に変化するような時は、、、

ろ過した硝酸カリウムの結晶に銅イオンが含まれているということになってしまいます。
分離操作がうまくいかなかったということです
また、塩化バリウム水溶液を加えて、白色に濁る(沈殿する)場合は、硫酸銅の硫酸イオンと反応して硫酸バリウムが生成されたということなので、分離操作失敗ということになります
実験操作は、溶解、加熱、ろ過、再結晶などなど、かんたんな基本操作ばかり。
本来の実験書には操作 のところで2本の試験管を用意し、同じように操作して分量の違いによる結果を考察するという少し高度なものでした。
のところで2本の試験管を用意し、同じように操作して分量の違いによる結果を考察するという少し高度なものでした。
使用していない硝酸カリウムはたくさんあるので、来年から実験プリントを変更して挑戦してもいいかもしれません
試行錯誤してみます